COLTIVAZIONE - L'agar
 IMPORTANTE: se non hai una pentola a pressione, leggi la guida introduttiva per un consiglio d'acquisto o per le alternative
IMPORTANTE: se non hai una pentola a pressione, leggi la guida introduttiva per un consiglio d'acquisto o per le alternative
Se hai letto la guida introduttiva, avrai trovato menzione dell'agar. L'utilizzo dell'agar è pratica comune in ogni laboratorio microbiologico: è uno strumento potente e non difficile da usare che sta alla base della coltivazione in bulk, ma che torna utile in ogni metodo di coltivazione. Attraverso alcuni accorgimenti, è possibile replicare in casa quello che è generalmente limitato ad un laboratorio, con un investimento minimale. Vediamo in cosa consiste.
Per evitare incongruenze, da qui in poi mi riferirò alla polvere come agar agar, e alla miscela di agar agar e altre sostanze solamente come agar.
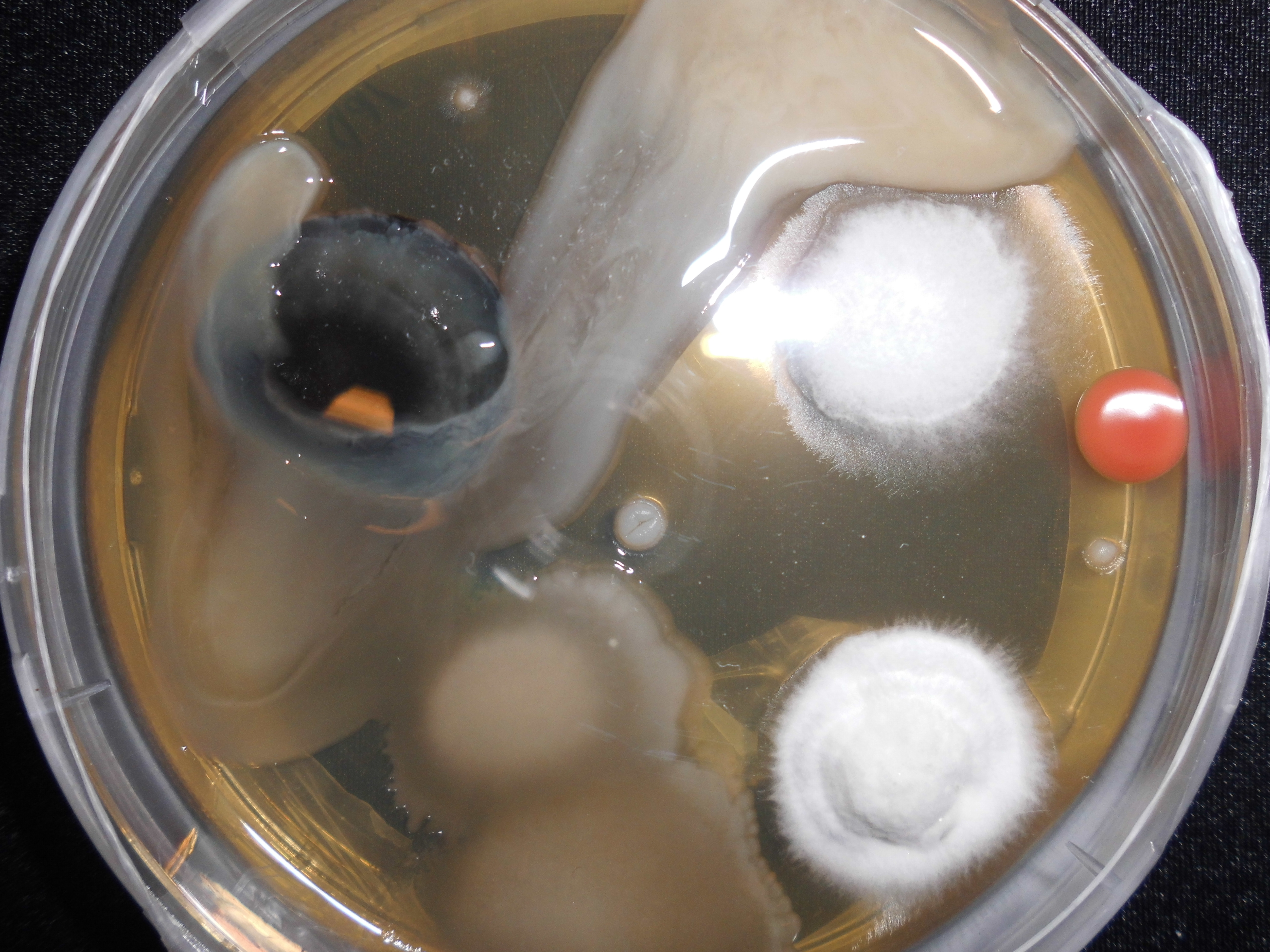
 L'agar agar è una gelatina vegetale usata anche in cucina in diverse preparazioni. Ha diverse proprietà peculiari che lo rendono adatto all'utilizzo in laboratorio: oltre gli 80 °C è liquido, mentre quando scende sotto i 50 °C comincia a solidificarsi, ed è solido a temperatura ambiente. L'agar agar, addizionato ad acqua e a varie sostanze nutrienti, forza i microorganismi a crescere su un piano bidimensionale, in quanto non è digeribile dalla maggior parte di questi. Tale caratteristica permette, lavorando in ambiente sterile, di selezionarli e separarli con facilità. L'immagine a destra mostra una piastra di Petri (contenitore circolare basso e piatto) contenente dell'agar su cui crescono diverse muffe e batteri. Ogni singolo tipo di microorganismo forma colonie ben distinguibili, ed è facilmente isolabile trasferendone una porzione su dell'agar vergine. Questa pratica è applicabile anche al micelio fungino che può anch'esso essere coltivato su agar, potendolo così isolare da altri microorganismi contaminanti indesiderati. Avere del micelio “pulito”, che non sia contaminato da alcun batterio o muffa, permette di eliminare alla sorgente ogni possibile contaminazione dell'inoculante (spore). Inoltre con l'agar non dovrete più comprare spore o preoccuparvi di siringhe contaminate, in quanto è possibile propagare il micelio all'infinito su agar una volta pulito. Si possono anche isolare su agar genetiche di funghi allettanti (clonazione), permettendo di avere raccolti più uniformi e performanti della coltivazione a partire da spore.
L'agar agar è una gelatina vegetale usata anche in cucina in diverse preparazioni. Ha diverse proprietà peculiari che lo rendono adatto all'utilizzo in laboratorio: oltre gli 80 °C è liquido, mentre quando scende sotto i 50 °C comincia a solidificarsi, ed è solido a temperatura ambiente. L'agar agar, addizionato ad acqua e a varie sostanze nutrienti, forza i microorganismi a crescere su un piano bidimensionale, in quanto non è digeribile dalla maggior parte di questi. Tale caratteristica permette, lavorando in ambiente sterile, di selezionarli e separarli con facilità. L'immagine a destra mostra una piastra di Petri (contenitore circolare basso e piatto) contenente dell'agar su cui crescono diverse muffe e batteri. Ogni singolo tipo di microorganismo forma colonie ben distinguibili, ed è facilmente isolabile trasferendone una porzione su dell'agar vergine. Questa pratica è applicabile anche al micelio fungino che può anch'esso essere coltivato su agar, potendolo così isolare da altri microorganismi contaminanti indesiderati. Avere del micelio “pulito”, che non sia contaminato da alcun batterio o muffa, permette di eliminare alla sorgente ogni possibile contaminazione dell'inoculante (spore). Inoltre con l'agar non dovrete più comprare spore o preoccuparvi di siringhe contaminate, in quanto è possibile propagare il micelio all'infinito su agar una volta pulito. Si possono anche isolare su agar genetiche di funghi allettanti (clonazione), permettendo di avere raccolti più uniformi e performanti della coltivazione a partire da spore.
Preparazione
Premesso che esistono numerose ricette (link a fine pagina), la ricetta che seguirò è quella per la preparazione del PDA (potato dextrose agar).
Per preparare 250 ml di agar serviranno i seguenti ingredienti:
- Agar agar 5 grammi, si trova in tutti i supermercati nel reparto dolci in forma di polvere, alternativamente in negozi di alimentari cinesi o su internet. Non è necessario acquistare agar agar costoso da laboratorio. USARE MENO AGAR AGAR SE SI HA INTENZIONE DI GERMINARE DELLE SPORE (anche metà della dose indicata)
- Acqua 250 ml, va bene quella del rubinetto
- Patate 50 grammi, da lavare per bene ma non sbucciare
- Glucosio 5 grammi, acquistabile come integratore da negozi di articoli sportivi o nei supermercati ben forniti, alternativamente su internet. Si può sostituire all'occorrenza con miele (va calcolato l'equivalente in peso leggendo i carboidrati sull'etichetta, in quanto è costituito anche da una percentuale d'acqua), fruttosio o saccarosio (non consigliato).
- Pentola a pressione
- Bottiglia in cui sterilizzare l'agar, va bene una bottiglia di vetro con tappo in metallo della passata di pomodoro (possibilmente piccola), ma consiglio di acquistare una bottiglia come quella in foto. È facilmente reperibile online e ideale per sterilizzare l'agar
- Bilancia di precisione, deve misurare almeno il decimo di grammo, anche questa reperibile online per pochi soldi
- Bilancia da cucina, opzionale, è un modo più accurato di misurare il volume d'acqua
- Forno a microonde o pentolino per sciogliere l'agar agar, è opzionale in quanto la pentola a pressione genera calore a sufficienza, ma questo passaggio evita che si formino grumi soprattutto se si preparano grandi quantità di agar
- Termometro, sconsiglio quelli analogici al mercurio o simili in quanto è necessario un monitoraggio in tempo reale e non sono il massimo dell'accuratezza. Io uso un termometro digitale, economico, di quelli da cucina per misurare la temperatura delle bistecche
- SAB o cappa a flusso laminare (vedi la guida introduttiva)
- Cannello a gas, io non lo ho e uso la fiamma del fornello di casa, per quanto scomoda. Servirà ad arroventare gli attrezzi
- Bisturi o taglierino di precisione in metallo (senza parti in plastica che si scioglierebbero)
- Loop di inoculazione è possibile acquistare quelli usa e getta o prepararne uno (vedi link utili)
- Pellicola trasparente o parafilm, il parafilm è quello che si usa in laboratorio. Ha il vantaggio di essere traspirante rispetto alla pellicola che si usa in cucina ma è decisamente più costoso e difficile da reperire se non online. Se si usa la pellicola trasparente, tagliare il rotolo in rotoli più piccoli di circa 3 centimetri
- Piastre di Petri, serviranno a contenere l'agar, sono basse e larghe con un coperchio trasparente che permette di vedere chiaramente la superficie dell'agar. Esistono sia in vetro riutilizzabili che in plastica monouso. Quelle in plastica costano un po' di più nel lungo termine, soprattutto se si contano quelle che andranno sacrificate nelle prime fasi di pratica, ma il loro utilizzo è più immediato in quanto sono vendute già sterili
- Carta stagnola
Prima fase: brodo di patate e sterilizzazione
Lavare bene le patate sotto acqua a corrente rimuovendo residui i residui di terra. Tagliarle a cubetti senza sbucciarle e farle bollire per mezz'ora a fuoco basso nella quantità d'acqua indicata. È possibile preparare più brodo di quello necessario e conservarlo in freezer per utilizzo successivo.
Trasferire il brodo all'interno della bottiglia in cui si sterilizzerà l'agar, pesando su una bilancia (1 grammo di acqua equivale a 1 ml). Aggiungere l'acqua necessaria per riportare al volume di partenza dopo che parte è evaporata. Aggiungere lo zucchero (glucosio o una delle alternative) e l'agar agar e scaldare nel forno a microonde (se il tappo della bottiglia è in metallo rimuoverlo). È importante tenere d'occhio la bottiglia perché l'agar tende a bollire fuori. Far bollire finché si presenta una soluzione omogenea senza grumi.
Se il brodo di patate è stato preparato sul momento, la soluzione non sarà perfettamente limpida. Questo non compromette l'efficacia dell'agar, ma può essere esteticamente più comodo avere una soluzione limpida. Per ottenere una soluzione limpida è necessario lasciar raffreddare il brodo e decantarlo. Se è stato preparato in un momento precedente e conservato in freezer il residuo opaco si depositerà sul fondo una volta scongelato e sarà facile da separare.
Chiudere la bottiglia con il tappo ma tenerlo allentato per evitare che formi un sigillo a vuoto in pentola a pressione. Coprire il tappo e parte del collo con un pezzo di carta stagnola (servirà a proteggere il tappo allentato dai batteri presenti nell'aria a sterilizzazione effettuata).
A questo punto sterilizzare in pentola a pressione per almeno 20 minuti a 15 psi (100 kPa). Se si usano piastre di Petri in vetro è possibile sterilizzarle insieme all'agar (vedi questa sezione per dettagli aggiuntivi).
N.B.: È necessario far sfiatare il vapore dalla valvola per una decina di minuti prima di chiuderla (la valvola), questo serve a rimuovere l'aria presente all'interno che renderebbe la sterilizzazione meno efficace. Il timer per la sterilizzazione parte dal momento in cui la pentola raggiunge la pressione di 15 psi, non prima.
Seconda fase: bagno di raffreddamento e versamento delle piastre
Una volta terminata la sterilizzazione, è necessario portare l'agar alla temperatura giusta prima di poterlo versare nelle piastre. Versare a una temperatura troppo bassa porterà alla formazione di grumi e a una superficie non piatta (non causa particolari problemi, ma è davvero brutta); una temperatura troppo alta porterà a condensazione sui coperchi delle piastre, soprattutto se si lavora in una SAB e non in una cappa a flusso laminare, dove è possibile far solidificare le piastre di Petri senza il coperchio. La condensa se non eccessiva non è un problema, ma impedisce di vedere chiaramente il contenuto della piastra.
Il modo migliore per portare l'agar alla temperatura desiderata è costruire un bagno di raffreddamento. Procurarsi un contenitore più grande della bottiglia, e riporvi la bottiglia al suo interno dopo aver avvitato il tappo (senza rimuovere la stagnola). Riempire con acqua bollente (va bene dal rubinetto) fino a raggiungere il livello della soluzione di agar all'interno della bottiglia. Usare un contenitore più piccolo possibile, in quanto usare un quantità di acqua per il raffreddamento proporzionata a quella di agar permette un controllo della temperatura più accurato.
 Con il termometro tenere costantemente d'occhio la temperatura, che diminuirà molto lentamente. Non bisogna avere fretta in questo passaggio. Ogni tanto muovere su e giù la bottiglia per uniformare la temperatura dell'acqua del bagno di raffreddamento. L'agar comincia a solidificare intorno ai 40 °C, quindi è necessario versarlo prima che raggiunga questa temperatura. La temperatura esatta dipende dall'agar, in quanto diverse marche possono variare di alcuni gradi ed è necessario sperimentare per scoprire quanto in basso si possa scendere. Nel dubbio, 48 °C è un buon punto di partenza.
Con il termometro tenere costantemente d'occhio la temperatura, che diminuirà molto lentamente. Non bisogna avere fretta in questo passaggio. Ogni tanto muovere su e giù la bottiglia per uniformare la temperatura dell'acqua del bagno di raffreddamento. L'agar comincia a solidificare intorno ai 40 °C, quindi è necessario versarlo prima che raggiunga questa temperatura. La temperatura esatta dipende dall'agar, in quanto diverse marche possono variare di alcuni gradi ed è necessario sperimentare per scoprire quanto in basso si possa scendere. Nel dubbio, 48 °C è un buon punto di partenza.
Nel frattempo, spruzzare le pareti della SAB con acqua saponata e trasferire all'interno le Petri ancora avvolte nel loro involucro. Quando l'agar raggiunge la temperatura, trasferire anche la bottiglia, spruzzare l'aria all'interno della SAB e aspettare un paio di minuti affinché i microorganismi presenti si posino.
Rimuovere la stagnola dalla bottiglia e togliere il tappo: da qui in poi non bisognerà più passare con le mani sopra l'apertura della bottiglia per evitare che batteri cadano al suo interno. Estrarre le piastre di Petri dal loro involucro e mentre con una mano si solleva il coperchio di una, versare con un movimento di polso l'agar dalla bottiglia. Procedere fino a riempire tutte le piastre per un massimo di mezzo centimetro (anche meno) e disporle in una pila. Coprire i buchi della SAB con della pellicola trasparente e lasciar raffreddare per almeno due ore (volendo anche tutta la notte). La piastra in cima alla pila vedrà il coperchio raffreddarsi più velocemente della base, e di conseguenza presenterà della condensa. Se lo si desidera è possibile rimuoverla appoggiando sul coperchio della piastra una tazza con dell'acqua bollente.
Germinazione delle spore
 Una volte preparate le piastre di Petri con l'agar, procediamo alla germinazione delle spore. Germinare le spore su agar permette di verificare la presenza di microorganismi estranei ed eventualmente eliminarli. È importante che l'agar sia più morbido del solito (meno agar agar), in quanto un agar troppo duro rende difficile se non impossibile la germinazione.
Una volte preparate le piastre di Petri con l'agar, procediamo alla germinazione delle spore. Germinare le spore su agar permette di verificare la presenza di microorganismi estranei ed eventualmente eliminarli. È importante che l'agar sia più morbido del solito (meno agar agar), in quanto un agar troppo duro rende difficile se non impossibile la germinazione.
A seconda della forma in cui sono le nostre spore, il procedimento è un po' diverso. Se le spore sono in forma liquida, dopo aver arroventato l'ago della siringa su una fiamma fino a che diventi arancione, portare la siringa all'interno della SAB, aspettare un paio di secondi affinché si raffreddi l'ago, e depositare una o due gocce di liquido su una piastra di Petri. Non è necessario abbondare con il liquido, che causa più problemi che altro. La quantità di spore in una goccia è più che sufficiente per garantire la germinazione. Opzionalmente, è possibile usare il loop di inoculazione (dopo averlo arroventato all'esterno della SAB) per spargere il liquido sulla superficie della piastra.
Se le nostre spore sono in forma di impronta sporale, il procedimento è più semplice. Arroventare il loop di inoculazione e appoggiarlo sulla superficie dell'agar per raffreddarlo. Procedere quindi a raschiare una piccola quantità di spore e a trasferirla sulla superficie dell'agar, distribuendola con un movimento a zig-zag.
Una volta preparate diverse piastre di germinazione (sempre meglio farne più di una), procedere a sigillarne il bordo con il parafilm o con i rotolini di pellicola trasparente. A questo punto è possibile rimuoverle dall'interno della SAB e aspettare che mostrino colonizzazione. L'incubazione può avvenire a temperatura ambiente in assenza di un incubatore.
Ricordo ancora una volta l'importanza di non passare con mani o attrezzi non sterili sopra le piastre di Petri aperte. Se vedere comparire sulle vostre piastre colori e texture diverse dai filamenti bianchi del micelio, può essere indizio di una contaminazione iniziale delle spore ma anche di scarsa cautela nel maneggiarle all'interno della SAB da parte vostra.
Nei link utili è presente una pagina con diversi video che illustrano il processo.
Trasferimento
 Questo processo è probabilmente il più importante che sta alla base dell'utilizzo dell'agar.
Questo processo è probabilmente il più importante che sta alla base dell'utilizzo dell'agar.
Arroventare il bisturi sulla fiamma (eventualmente immergerlo in alcool per dare una fiammata anche a parte del manico) e toccarlo sulla superficie dell'agar vergine per raffreddarlo. Procedere a tagliare da un piastra di Petri colonizzata una piccola porzione di agar su cui cresca esclusivamente il microorganismo che si desidera isolare (nel nostro caso il micelio fungino) e non altri microorganismi. Trasferire il pezzetto di agar al centro di una piastra vergine e sigillare con pellicola/parafilm. Nei giorni successivi si vedrà il micelio scendere dal pezzetto di agar e colonizzare l'intera piastra. Consiglio di non infilzare il pezzettino con il bisturi per trasferirlo, ma di sollevarlo sulla punta, altrimenti risulterà difficile staccarlo.
Non è necessario che l'agar delle piastre sia più morbido, requisito necessario solo per la germinazione delle spore. Anche se la piastra di germinazione appare priva di contaminanti, consiglio di di fare almeno uno o due trasferimenti per sicurezza.
Da una stessa piastra è possibile effettuare almeno una decina se non più trasferimenti, è quindi possibile espandere esponenzialmente il micelio se lo si desidera, senza dover ripetere la germinazione.
Clonazione
 Le cellule che costituiscono il fungo sono totipotenti, ovvero hanno la capacità di rigenerare l'intero organismo. A partire da un piccolo pezzo di un fungo adulto è possibile rigenerare su agar il micelio, da cui è possibile generare altri funghi. Questo processo è noto come clonazione, in quanto il patrimonio genetico (che nella coltivazione da spore è assai vario) rimane costante e uguale attraverso questo tipo di riproduzione. I funghi che nasceranno dal micelio rigenerato avranno lo stesso patrimonio genetico del fungo di partenza. Questo permette di isolare genotipi particolarmente performanti (ad esempio un fungo più grande degli altri) e avere raccolti più uniformi nelle caratteristiche presentate, o rigenerare un fungo raccolto in natura. Nell'immagine a sinistra possiamo osservare un fungo raccolto ancora giovane che su agar ha rigenerato il micelio.
Le cellule che costituiscono il fungo sono totipotenti, ovvero hanno la capacità di rigenerare l'intero organismo. A partire da un piccolo pezzo di un fungo adulto è possibile rigenerare su agar il micelio, da cui è possibile generare altri funghi. Questo processo è noto come clonazione, in quanto il patrimonio genetico (che nella coltivazione da spore è assai vario) rimane costante e uguale attraverso questo tipo di riproduzione. I funghi che nasceranno dal micelio rigenerato avranno lo stesso patrimonio genetico del fungo di partenza. Questo permette di isolare genotipi particolarmente performanti (ad esempio un fungo più grande degli altri) e avere raccolti più uniformi nelle caratteristiche presentate, o rigenerare un fungo raccolto in natura. Nell'immagine a sinistra possiamo osservare un fungo raccolto ancora giovane che su agar ha rigenerato il micelio.
Il processo è abbastanza immediato: all'interno della SAB, dopo aver sterilizzato un bisturi, si spezza un fungo. Non utilizzare il bisturi per tagliarlo, in quanto si spingerebbero batteri presenti sulla superficie esterna all'interno del fungo. Con il bisturi sterilizzato si raschia una piccola porzione di tessuto dalla parte interna (che non deve venire a contatto con nient'altro oltre al bisturi) e la si appoggia sulla superficie di una piastra di Petri vergine. Sigillare come al solito, nei giorni successivi sarà possibile osservare il micelio crescere dal pezzo di fungo. Soprattutto se il fungo è stato raccolto in natura, è possibile che siano presenti dei contaminanti e che si rendano necessari uno o più trasferimenti (trasferire almeno una volta in ogni caso, per sicurezza).
Nei link utili è presente una pagina con diverse immagini che illustrano il processo.
Altre informazioni
Isolati
Non ho incluso questo paragrafo in quello riguardante la clonazione perché è un concetto che va oltre la clonazione e non volevo allungare troppo.
La selezione genetica e la produzione di isolati non è un concetto limitato alla clonazione. È possibile isolare a partire da una piastra di germinazione, facendo trasferimenti finché il micelio non crescerà in un cerchio perfetto, indizio abbastanza affidabile sulla presenza di un isolato. Nei link utili ho inserito una pagina (isolati 1) dove questo processo viene illustrato con immagini. Non è un procedimento che consiglio se non al coltivatore più appassionato, non tanto per la difficoltà quanto per il tempo che richiede. È impossibile distinguere dall'agar un isolato più performante da uno meno performante, è quindi necessario crescere effettivamente diversi isolati in condizioni analoghe per testarne le caratteristiche. Un esempio del processo dall'inizio alla fine si trova sempre nei link utili (isolati 2).
Tecnica sterile, una ricapitolazione
Data l'importanza dell'argomento, ho voluto aggiungere una breve ricapitolazione di accorgimenti importanti per utilizzare l'agar con successo.
- Lasciare le piastre di Petri sterili aperte il meno possibile. Per quanto l'aria all'interno della SAB sia ragionevolmente pulita, non è una cappa a flusso laminare, e tenere le piastre aperte più a lungo del necessario aumenta le probabilità di contaminazione
- Non passare con le mani o attrezzi non sterili al di sopra di superfici sterili (bottiglia dell'agar aperta, piastre di Petri aperte)
- Non toccare l'agar con attrezzi che non siano stati sterilizzati sulla fiamma precedentemente
- È buona norma dare una spruzzata all'aria all'interno della SAB, oltre che alle pareti, un paio di minuti prima di lavorarci
- Evitare movimenti bruschi quando si lavora all'interno della SAB per non creare turbolenza e movimenti d'aria. Lavorare con movimenti lenti e decisi.
Sterilizzare Petri in vetro
Se hai delle piastre di Petri in vetro dovrai sterilizzarle ogni volta che le utilizzi. A seconda della preferenza, è possibile sterilizzarle sia in forno che in pentola a pressione. In entrambi i casi devono essere ben pulite prima di essere sterilizzate: si possono lavare con dell'acqua e sapone e lasciarle asciugare all'aria oppure passarle con dell'alcool o prodotto per vetri.
Pentola a pressione
Impilare le piastre una sopra l'altra e avvolgerle bene con la stagnola. Sterilizzare in pentola a pressione insieme alla bottiglia di agar o separatamente. Io di solito ritaglio dei piccoli quadratini di carta da cucina (scottex), li piego e li metto tra una piastra e l'altra come spessore, più uno alla base della pila. Aiutano in primo luogo ad evitare che le Petri scivolino quando viene il momento di usarle, e in secondo luogo permettono di controllare se è entrata acqua. Il grosso dell'umidità dovrebbe essere sull'involucro esterno, la carta deve rimanere asciutta. Se è bagnata è necessario avvolgere la stagnola con più attenzione.
Forno
Alternativamente è possibile sterilizzare le Petri di vetro in forno. Vanno comunque avvolte bene, in quanto la stagnola serve a proteggerle dall'aria non sterile nel trasferimento all'interno della SAB. Nel forno, in quanto l'aria trasmette il calore molto meno efficacemente dei vapori d'acqua ad alta pressione, è necessaria almeno un'ora a 230 °C (meglio anche un po' più a lungo).
Alternative alle piastre di Petri: agar "no pour"
Alcuni preferiscono evitare di versare l'agar e lo versano comodamente già nei contenitori, prima di sterilizzare. Questa tecnica non può essere usata con le piastre di Petri in quanto sono troppo basse e la soluzione bollirebbe fuori dai bordi. Si possono utilizzare dei piccoli barattoli di vetro o in plastica (deve essere polipropilene, sigla PP, altrimenti si scioglie in pentola a pressione). Personalmente non amo questa opzione in quanto i contenitori occupano molto più spazio delle piastre di Petri, ma è sicuramente efficace, e risparmia il passaggio di dover versare l'agar dalla bottiglia all'interno della SAB.
Conservazione a lungo termine
È possibile conservare in frigo l'agar sia colonizzato che vergine. In questo modo si può costruire la propria “banca” di micelio con le diverse varietà isolate nell'arco del tempo, per eventuali coltivazioni future. Se il frigo è quello di casa e non uno dedicato, conservare le piastre in contenitori il più possibile isolati per tamponare gli sbalzi di temperatura di quando si apre la porta del frigorifero. È consigliabile effettuare un trasferimento almeno una volta all'anno a dell'agar vergine e lasciar colonizzare prima di refrigerare nuovamente per mantenere il micelio in salute. In questo modo è possibile conservare il micelio per molti anni.
Pagine collegate
COLTIVAZIONE - Dove iniziare
COLTIVAZIONE - Bulk: spawn e inoculanti
COLTIVAZIONE - Bulk: fruttificazione
COLTIVAZIONE - PFTek
Link utili
Shroomery - Ricette agar
Shroomery - BOD's Comprehensive Agar TEK
Shroomery - BOD's DIY Inoculation Loop TEK (loop di inoculazione)
Shroomery - Sterilizing glass petris
Shroomery - Video di coltivazione
Shroomery - How I do agar (enlightenment)
Shroomery - Frank's Proper Cloning Tek (clonazione)
Shroomery - Stro's Cleaning and Isolating On Agar (isolati 1)
Shroomery - 10 PE ISOLATES (isolati 2)
Wikipedia - Potato dextrose agar
